吴强、 王文
1. 引言
A群链球菌(Group A streptococcus, GAS)也称化脓性链球菌(Streptococcus pyogenes),是人类链球菌中致病力最强的细菌,引起的疾病约占人类链球菌感染的90%。A群链球菌在整个现代医学史上一直对科学家和临床医生造成挑战。由它所造成的对健康个体灾难性疾病的追溯可到17世纪。直到20世纪早期,由A群链球菌感染引起的猩红热和急性风湿热仍然是儿童死亡的一个主要原因。20世纪80年代,严重的侵袭性疾病,风湿热暴发流行和一种新出现的链球菌感染引起的中毒性休克在世界上许多国家出现[1]。即使在合适的抗生素治疗的情况下,这些侵袭性感染仍导致高死亡率。
2. 临床和流行病学特征
人类是GAS的唯一宿主,患者与带菌者是主要传染源,其传播仅在人与人间通过直接接触、空气飞沫以及污染的食物进行传播。个别情况下,也可通过皮肤黏膜接触传播。GAS主要定殖于人体黏膜表面,如口腔黏膜、胃肠道黏膜,也可定殖于男性生殖器等部位。人群对GAS普遍易感,多发于小于15岁的儿童、老年人以及免疫力低下者。
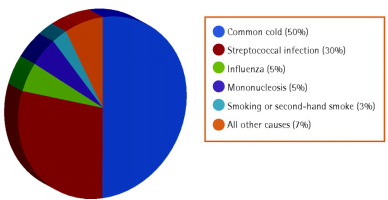
引起小孩咽喉炎的原因(图片引自Acute sore throat, www.cfp.ca)
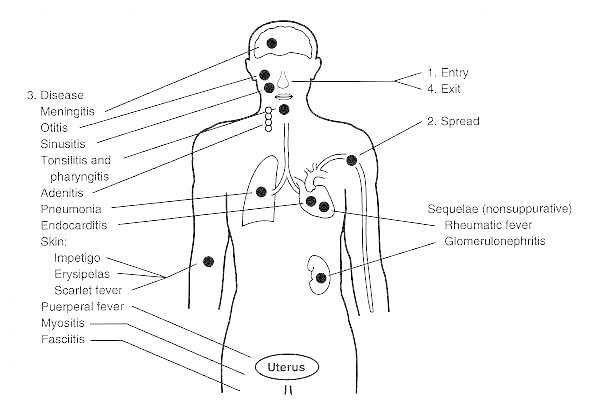
A群链球菌感染的发病机制(图片来自Medical Microbiology. 4th edition. Chapter 13 Streptococcus)
据世界卫生组织报道,目前全球每年有多于50万例患者死于链球菌感染所致的各种疾病[2],几乎都在低收入和中等收入国家。其中约30%患者死于链球菌的侵袭性感染,近70%患者死于链球菌感染后所致的风湿热、风湿性心脏病、急性肾小球炎等疾病。
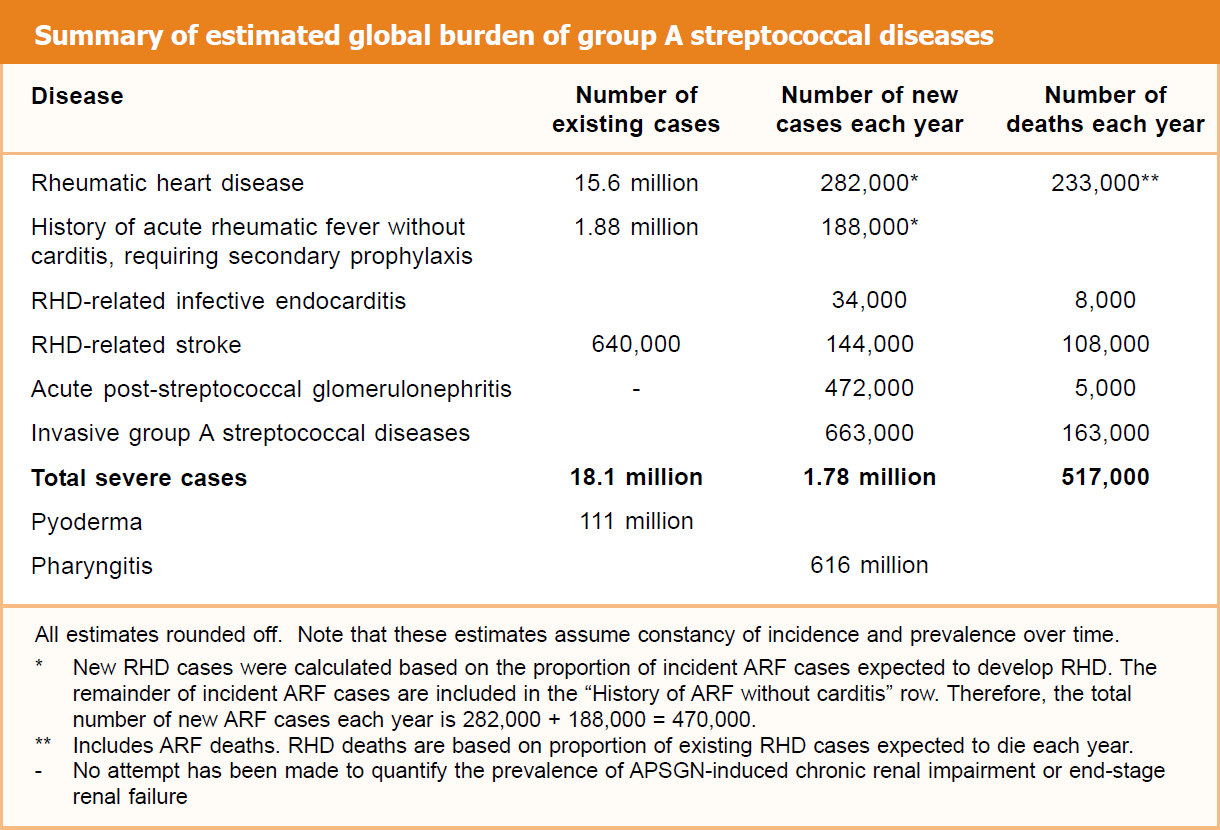
图片来自世界卫生组织网站(The Current Evidence for the Burden of Group A Streptococcal Diseases)
由A群链球菌感染引起的疾病可分为侵袭性、毒素性和变态反应性三类:
第一类,侵袭性疾病
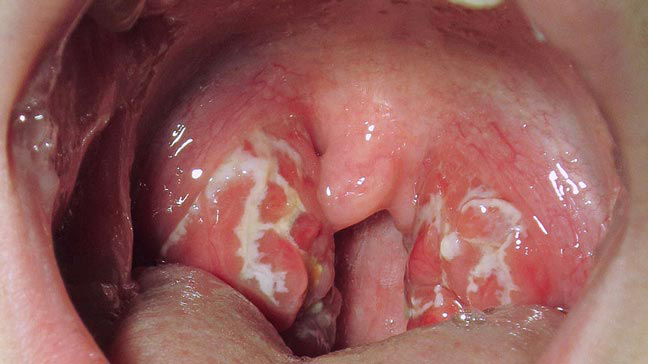
图片来源于网络(Strep Throat链球菌性咽炎)
(1)咽炎、皮肤及皮下组织急性化脓性炎症(脓疱病)是最常见的表现。(2)感染扩散到邻近组织或弥散到较深组织出现化脓性并发症:颈淋巴结炎、肺炎、丹毒、蜂窝组织炎、淋巴管炎、菌血症、脑膜炎、脓毒性关节炎、骨髓炎和产后子宫内膜炎。
第二类,毒素性疾病
(1)猩红热:由产生致热外毒素的A群链球菌引起的呼吸道传染病。多发于10岁以下儿童,潜伏期为2~3天,细菌经飞沫传播,黏附于咽部黏膜,引起全身中毒症状。临床特征为发热、全身弥漫性鲜红色皮疹及皮疹退后明显的脱屑。常继发严重的咽炎或皮肤软组织感染。少数还可见病毒性心肌炎、肾小球肾炎等病变。猩红热一年四季都可发生,尤以冬春发病为多。
(2)GAS中毒性休克(Streptococcal toxic shock syndrome, STSS):由A群链球菌所释放的毒素引起的,以休克和多脏器功能衰竭为特征的急性疾病,病死率可高达30%。
第三类,变态反应性疾病
(1)风湿热:由A群链球菌的多种型别引起,常继发于A群链球菌感染的咽炎,潜伏期为1~5周,易感人群为10岁以下儿童。临床表现以关节炎、心肌炎为主。
(2)急性肾小球肾炎:大多数由A群12型链球菌引起,多见于儿童和少年。临床表现为蛋白尿、浮肿和高血压。也是一种变态反应性疾病。

图片来源于网络
目前,治疗GAS感染的主要措施为应用抗生素,如青霉素、大环内酯类药物,或静脉注射免疫球蛋白。虽然没有报道显示GAS对青霉素有耐药性,但相关研究证实青霉素在GAS咽炎的治疗中失败率达20%~40%。而对大环内酯类敏感的GAS会利用生物膜形成隔离,成为逃避抗生素治疗的机制从而在宿主体内产生严重的GAS侵袭性感染,如链球菌毒性休克综合征和坏死性筋膜炎,静脉内注射免疫球蛋白以促进调理吞噬作用为辅助治疗手段,收到一定的疗效,但免疫球蛋白的弊端是只能提供短期保护。就目前形势来看,GAS感染已成为临床治疗中的棘手问题。所以,对于GAS的有效防治,除了控制传染源外,应用疫苗成为最有效的措施。
3. A群链球菌疫苗的研究
由于各种原因,迄今为止仍然没有安全有效的GAS疫苗供人类使用。导致这一现象的原因如下:
(1)GAS的血清型众多(约200种),而各血清型之间又很少存在交叉,不可能构建一种疫苗可包含所有血清型,因此很难开发出一种针对所有流行菌株的疫苗。这就要求根据某一地区、某一时段GAS的流行趋势选取相应血清设计疫苗,而该种疫苗只能对当地GAS感染有效,而且一旦流行菌株发生变化或出现新的菌株则保护效果大大降低。
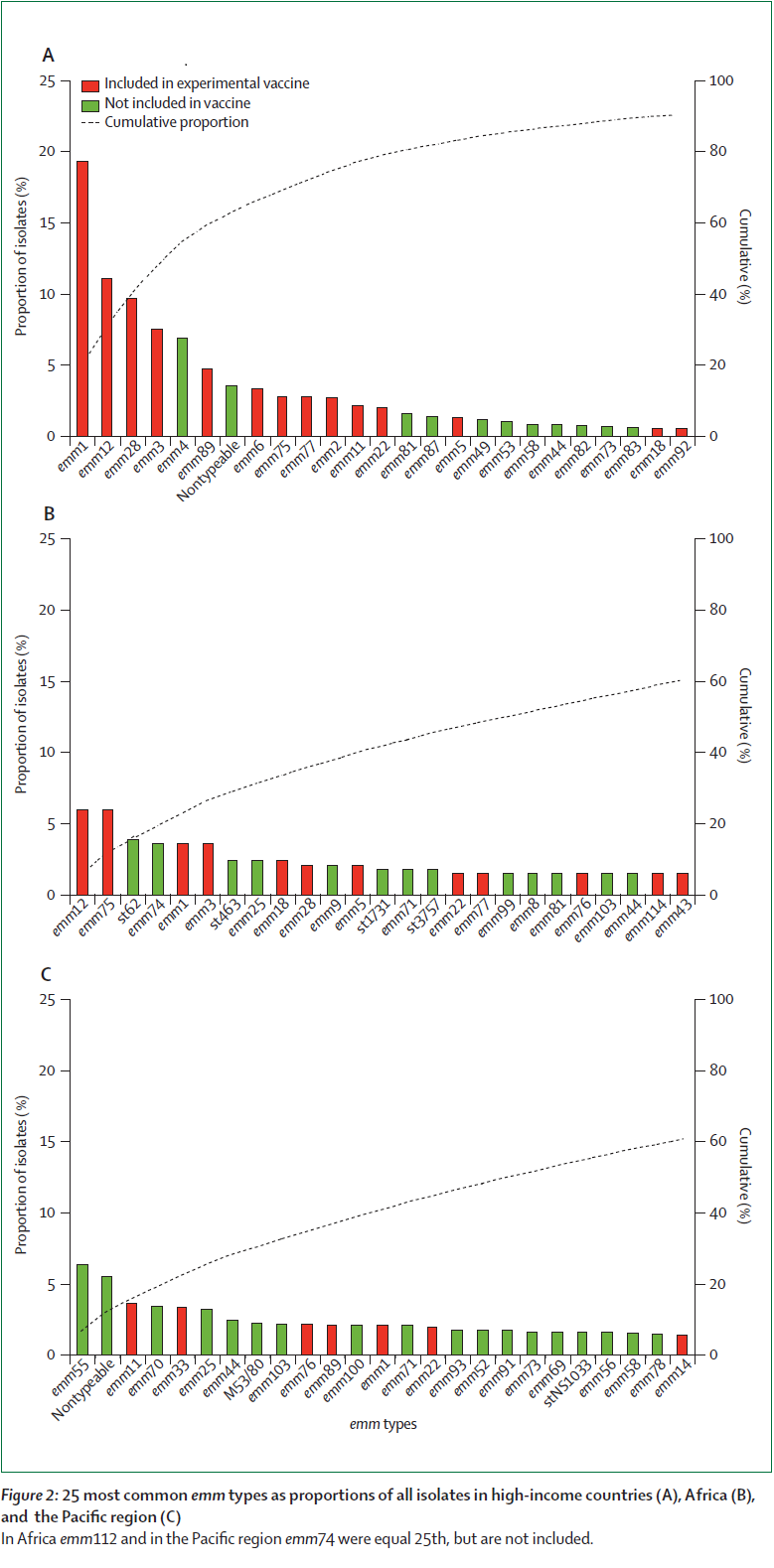
不同地区不同emm型GAS流行情况(图片引自Global emm type distribution of group A streptococci: systematic review and implications for vaccine development. )
(2)GAS的细胞壁M蛋白和多糖抗原与人体的许多组织蛋白存在共同的抗原表位,使得疫苗的应用面临着诱发自身免疫病的风险。20世纪70年代,美国研发的M蛋白提取疫苗在临床观察时,许多儿童接种过后出现了风湿热,于是美国FDA禁止了GAS疫苗的研发,此禁令直至2006年有效。因此一个可用的GAS疫苗必须排除所有与人类组织蛋白有交叉反应的抗原表位,这无疑给疫苗的筛选造成了困难。
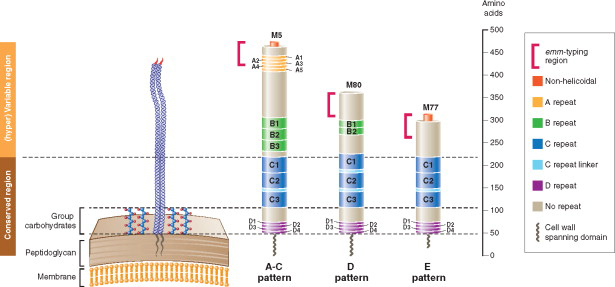
M蛋白(图片引自Current Approaches to Group A Streptococcal Vaccine Development)
3.1型特异性的M蛋白相关疫苗
Dale及其同事们发展了一种26价疫苗。这种疫苗由四种不同的重组融合蛋白组成,每种重组蛋白包含有6或7种GAS病例中频繁出现的典型血清型或是历史上出现致风湿病的M蛋白片段。这种26价疫苗的I期临床实验已经完成,实验结果表明这种26价疫苗是安全的,具有良好的耐受性和很高的免疫原性[3]。目前该疫苗的Ⅱ期临床实验正在进行。
但是这种型特异性的多价疫苗也存在很大的不足。流行病学研究表明,GAS有超过200个基因型,不同流行区域的基因型存在较大的差异。例如在亚洲、非洲流行的GAS基因型只有一小部分被纳入前文所述的26价疫苗中[4]。因此型特异性的多价疫苗在这些地区的作用会大大的降低。Steer等人的研究表明,26价疫苗在发达国家能够给予良好的保护率(≥72%),但在中低收入国家保护率却很低(24% ~39%)[5]。
Dale及其同事们之后又发展出30价疫苗。30价多肽疫苗增加了GAS流行菌株血清型的覆盖范围,能够诱发72种GAS基因型产生免疫调理抗体,其中包括30个疫苗包含的基因型和42个未包含的基因型[6]。
2.3非型特异性的M蛋白相关疫苗
以M蛋白C端保守区保护性表位为基础的多肽疫苗提供了另一个新的思路。澳大利亚格里菲斯大学Michael Good研究团队从M蛋白C末端区筛选出一种由12个氨基酸组成的肽段片段,是最小的B细胞抗原表位,与白喉类毒素进行结合形成J8肽候选疫苗(J8-DT)。大量的试验表明,配合铝佐剂使用,小鼠皮下注射J8疫苗能够产生具有血清调理作用的IgG抗体,这些抗体不论是主动还是被动免疫试验中都对机体具有保护作用,并能交叉保护来自其他M血清型GAS感染。并且,研究还表明J8疫苗诱导的血清IgG抗体不与人体组织发生交叉免疫反应。目前J8-肽疫苗已经进入I期临床试验阶段。
脂质体药物载体(图片来源于网络)
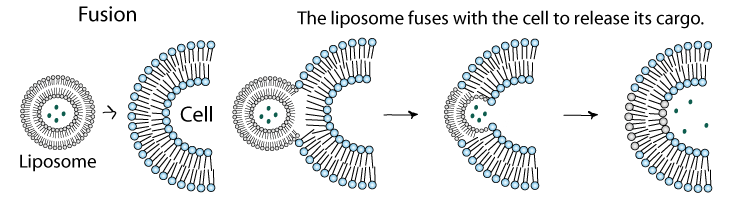
脂质体药物载体与细胞融合释放药物(图片来源于网络)
然而,对上呼吸道感染的保护需要IgA抗体。IgA保护需要黏膜免疫,虽然有在动物体内能有效诱导黏膜免疫反应的佐剂(如霍乱毒素B亚单位),然而并没有黏膜免疫佐剂被批准用于人体[7]。澳大利亚格里菲斯大学Michael Good研究团队最近与成都欧林生物科技股份有限公司在第一代J8肽疫苗的基础上进行了第二代J8肽疫苗的开发。该产品采用将J8肽化学结合到包裹DT的脂质体上。这是世界上首个采用口服给药的GAS疫苗,目前该产品尚处于临床前研究阶段。
参考文献
[1] Schwartz B, Facklam RR, et al. Changing epidemiology of group A streptococcal infection in the USA. Lancet 336:1167-1171,1990
[2] Sanyahumbi AS, Colquhoun S, et al. Streptococcus pyogenes Basic Biology to Clinical Manifestations. Oklahoma City, OK, USA: University of Oklahoma Health Sciences Center; 2016. p. 661- 704.
[3] McNeil AS, Halpenrin SA, et al. Safety and immunogenicity of 26-valent Group A Streptococcus vaccine in healthy adult volunteers. Clin Infect Dis 2005,41:1114-1122
[4] Jose JM. Molecular Characterization and Virulence Profiles of Group AStreptococci Causing Human Infection in a South Indian Community. PhD Thesis Submitted to The Dr. MGR Medical University, Chennai, Tamil Nadu, India; July, 2009.
[5] Tewodros W, Kronvall G. M protein gene (emm type) analysis of group A betahemolytic streptococci from Ethiopia reveals unique patterns. J Clin Microbiol 2005;43:4369-76
[5] Steer AC, Law I, Matatolu L, Beall BW, Carapetis JR. Global emm type distribu-tion of Group A Streptococci: systematic review and implications for vaccinedevelopment. Lancet Infect Dis 2009;9:611–6.)
[6] Dale JB, Batzloff MR, Cleary PP, Courtney HS, Good MF, Grandi G, et al. Current approaches to group A Streptococcal vaccine development. In: Ferretti JJ, Stevens DL, Fischetti VA, editors. Streptococcus pyogenes Basic Biology to Clinical Manifestations. Oklahoma City, OK, USA: University of Oklahoma Health Sciences Center; 2016. p. 938-84.)
[7] lee,S &Nguyen,MT. Recent advances of vaccine adjuvants for infectious diseases. Immune Netw 15,51-57,doi:10.4110/in 2015,15,2,51
[8] Zaman M, Ozberk V, Langshaw EL, McPhun V, Powell JL, Phillips ZN, Ho MF, Calcutt A, Batzloff MR, Toth I, Hill GR, Pandey M, Good MF. Novel platform technology for modular mucosal vaccine that protects against streptococcus. Scientific reports, 2016 Dec 15;6:39274. doi: 10.1038/srep39274