原创:InMed编辑部 Vaccine前沿
原文链接:https://mp.weixin.qq.com/s/_X8LWphaCjZ4ID4fXs3tjQ
A族链球菌(Group A Streptococcus,GAS)是一种非常重要的致病菌,是造成全球儿童死亡的十大感染性疾病病原之一。近年来,猩红热在世界范围内卷土重来,引起了国内外学者的再度关注。
01链球菌Streptococcus
链球菌的发现与研究,至今已持续了近两百年时间。1874年,奥地利外科医师Billroth在丹毒和伤口感染患者中首次描述了链球菌。1879年,Louis Pasteur 从产褥热妇女的子宫和血液中首次分离出该菌。1932年,Andrewes和Christie统一将以上不同疾病观察到的链状球菌命名为化脓性链球菌(Streptococcus pyogenes)。
链球菌的显微形态(图源:网络)
链球菌的病原学
化脓性链球菌分类学上归于链球菌属,该属细菌传统的分类依据溶血反应和携带的兰氏抗原等命名。
(1)根据溶血反应分为:
①甲(α)型溶血(不完全溶血);
②乙(β)型溶血(完全溶血);
③丙(γ)型溶血(不溶血)。
化脓性链球菌通常为β-溶血。
(2)根据族特异性抗原(Lancefield分型):1933年Lancefield根据链球菌表面的多糖抗原差异将链球菌分为18~20个族(组或群),该方法仍沿用至今。其中,对人体致病的以A族为主,还有B、C、D、F、G族等。
GAS常定植于人体咽部,也可以在不洁皮肤表面,引起浅表性感染、侵袭性感染、毒素介导性疾病以及感染后免疫性疾病。人类是GAS的唯一宿主,主要通过空气飞沫、皮肤黏膜接触传播,卫生条件差、居住拥挤等均有利于GAS传播,引发感染。此外,GAS也可通过污染的食物传播。人群对GAS普遍易感,发病者多为5~15岁儿童、老年人及免疫力低下者。
2005年世界卫生组织(World Health Organization,WHO)评估报告全球有严重GAS感染1 800万,每年新增1.1亿脓疱疮、6.1亿GAS急性咽/扁桃体炎、178万严重感染病例和51.7万死亡病例,目前世界上发达国家GAS感染发病率已显著下降,低收入和贫穷国家疾病负担仍较高。在全球范围内,GAS感染是导致发病和死亡的重要原因。但受到实验室诊断的技术和规模限制,GAS造成的疾病负担在我国尚未知,从而也未得到足够的重视。
GAS感染的致病机制
GAS的致病性与其产生的多种毒力因子有关,这些毒力因子通过促进细菌与宿主细胞的黏附,侵入深层组织、导致疾病的发生。目前已发现的毒力因子可分为菌体成分和分泌成分两类。
1.菌体成分
指菌体结构性毒力因子,主要包括细菌表面蛋白、荚膜、菌毛等,与增强病原体对宿主细胞的黏附能力、促进细菌逃避宿主免疫防御机制有关。
表面蛋白主要为M蛋白,是最重要的菌体蛋白成分,也是GAS最主要的毒力因子之一和血清分型依据,是由Mga调节子内的emm基因编码。emm基因分型是目前全世界公认的GAS分子分型方法,是基于编码M蛋白的emm基因多态性进行的序列分析。M蛋白的一些特定区域也可能作为共同抗原,与人体某些抗原成分发生交叉反应,引起自身免疫性疾病,如风湿热等。
荚膜主要成分为透明质酸,具有抗吞噬作用及连接宿主上皮细胞CD44的能力,是定植咽部的重要黏附因子。菌毛具有连接噬菌体、转运DNA、形成生物被膜、侵袭宿主细胞等功能。
2.分泌成分
指GAS产生的多种分泌性毒力因子,如链球菌致热外毒素、胞壁蛋白酶、分泌性脂酶、链球菌溶血素、透明质酸酶等,多与此菌破坏宿主细胞、干扰免疫系统有关。
超抗原是GAS研究中最受关注的一类毒力因子,分子质量相对较低,分泌后裂解释放成熟毒素,是已知最强有力的T细胞激活剂之一,在链球菌感染致病过程中发挥重要作用,可促进链球菌的定植、增殖和传播。
链球菌超抗原与一系列GAS疾病有关,包括侵袭性感染(如坏死性筋膜炎)、链球菌中毒性休克综合征(Streptococcaltoxic-shock syndrome,STSS)、川崎病、银屑病和急性风湿热(acute rheumatic fever,ARF)等。
GAS感染所致疾病
要知道,人类约90%的链球菌感染,都是由A族链球菌引起的。常见的传播方式为通过呼吸道传播,在炎热的季节多为皮肤感染。感染类型可归为三种主要类型:
1.化脓性感染
(1)局部皮肤及皮下组织感染:丹毒、淋巴管炎、蜂窝组织炎、痈、脓疱疮等。
(2)其它系统感染:化脓性扁桃体炎、咽炎、鼻窦炎、中耳炎及产褥热等。
2.中毒性疾病
(1)猩红热:由产生致热外毒素的A族链球菌引起的呼吸道传染病。此病多发于10岁以下儿童,潜伏期为2~3天,临床特征为发热、全身弥漫性鲜红色皮疹及皮疹退后明显的脱屑。此病常可继发于严重的咽炎或皮肤软组织感染。
(2)链球菌毒性休克综合征:由产生链球菌毒性休克综合征毒素的A族链球菌引起的以休克为主要症状的感染。可继发于皮肤伤口的感染。此病常伴有呼吸系统、及其它多个脏器功能的衰竭。病死率可高达30%。
3.变态反应性疾病
(1)风湿热:常继发于A族链球菌感染的咽炎,潜伏期为1~5周,易感人群为10岁以下儿童。典型的临床症状及体征为发热、不适、游走性、非化脓性、多发性的关节炎以及全心炎(心内膜炎、心肌炎、心包炎)。严重者可导致心瓣膜肥厚、变形。
从风湿热患者的上呼吸道中可分离出A族链球菌,但心脏及关节病变部位均未分离出细菌。风湿热可能的发病机制是链球菌菌体表面M抗原及细胞壁中的多糖抗原与心瓣膜及心肌组织存在抗原性的交叉反应,导致机体的免疫病理损伤。
风湿热患者在发病前,常有反复发作的A族链球菌咽炎。初次发作的风湿热,可能导致心脏的轻微损伤,然而反复发作则可加剧心脏的损伤。因此,预防A族链球菌的反复感染是防止风湿热的重要环节。
(2)急性肾小球肾炎:风湿热患者仅能从上呼吸道中分离出A族链球菌,而在急性肾小球肾炎患者的上呼吸道及皮肤感染灶中(如脓疱病)均可分离出A族链球菌。如今已证实,A族链球菌引起的上呼吸道及皮肤感染均可继发急性肾小球肾炎。
从流行病学角度分析两种继发感染存在明显的差异:继发于上呼吸道感染的急性肾小球肾炎发生在一年中寒冷的季节,易感人群多为儿童及青少年;而继发于皮肤感染的急性肾小球肾炎发生在热而潮湿的季节,易感人群可为所有年龄的人。与风湿热不同,感染恢复后急性肾小球肾炎极少复发。
急性肾小球肾炎的典型临床表现为链球菌引起上呼吸道或皮肤感染后约3周左右,患者出现血尿、蛋白尿、浮肿、尿素氮滞留、血清补体水平下降。大部分人可康复,少数病例可转变为慢性肾小球肾炎、肾功能衰竭。
急性肾小球肾炎的发病机制尚未完全清楚,推断有两种途径:
①链球菌菌体抗原与机体产生的相应抗体形成抗原抗体复合物沉积于肾小球基底膜,激活补体导致肾小球基底膜损伤;
②肾小球基底膜成分与A族链球菌膜表面结构有共同的抗原决定簇,导致肾小球基底膜发生免疫病理损伤。
GAS感染的免疫性
感染A族链球菌后,机体可获得对同型链球菌的特异型免疫力。
抗链球菌M蛋白抗体于链球菌感染几周至几个月内即可在血清中测出,在体内可存在1~2年,长者可持续存在10~30年。试验证明抗M蛋白特异性抗体可防止同型链球菌的再次感染。
M蛋白能干扰宿主细胞对细菌的吞噬,在M蛋白型特异性抗体存在时,链球菌很快被机体的吞噬细胞杀灭,故抗链球菌感染的免疫力仅对同型细菌有保护作用。根据M蛋白的不同,A族链球菌至少存在60个型,各型间无交叉免疫力。因此,机体可因侵入不同型别的细菌而导致链球菌的反复感染。链球菌感染后,机体可获得ASO,此抗体虽可阻断由溶血素O的溶血现象,但对链球菌的再次感染无保护作用。
从GAS的致病机制中可以看出,GAS的反复感染是造成严重疾病发生的重要成因。而GAS感染后的伴发疾病,往往难以诊断成因,导致错误治疗和长期反复感染,进一步影响高危人群健康。如何有效预防GAS,将链球菌引发的疾病“扼死”在感染关,降低相关死亡率,是一个值得研究的问题。
02疫苗开发VaccineDevelopment
疫苗接种是人类已知的最成功的卫生干预措施之一,在提到“预防”某种传染病时,无论是医疗从业人员还是普罗大众,第一个联想到的一定是“疫苗接种”。对于GAS感染的预防,疫苗究竟有什么可以挖掘的价值呢?
在控制GAS的第一步,我们就需要思考,如何防止GAS在人群中大规模传播。出于这一目标,抗生素治疗和静脉注射免疫球蛋白等替代疗法,不仅不适用于在人群层面上控制化脓性链球菌或A族链球菌(STREP A)感染,也无法阻止社区内传播。
在治疗层面上,抗菌素耐药性(AMR)的出现和加剧,令世界卫生组织和美国疾病控制与预防中心(CDC)都在反复、多次强调,疫苗在阻遏AMR的持续发生中可作为紧急保障措施(相关阅读:Vaccines:细菌疫苗或能遏制抗生素耐药进程)。为了更好地控制与A族链球菌相关的发病率和死亡率,我们需要安全有效的A族链球菌特异性疫苗。
A族链球菌作为一种主要的全球性传播病原体,其疾病表现从链球菌咽炎、脓疱病到猩红热,以及中毒性休克综合征和坏死性筋膜炎等侵袭性疾病。感染所致通常进展迅速,具有很强的传染性,进一步凸显了接种疫苗的必要性。
A族链球菌的侵袭性感染具有很高的死亡率和发病率,风湿性心脏病(RHD)等自身免疫后遗症引起的继发性疾病会导致重大的疾病负担,特别是在低收入和中等收入国家造成恶劣的健康影响。近年来,猩红热再次出现,尤其在英国和欧洲地区,特别令人担忧的是,在当前季节,与这些感染相关的败血症发病率也飞速上升,因此全球迫切需要开发一种抗A族链球菌的疫苗。鉴于目前人类是A族链球菌唯一的自然宿主,如果能够阻断其传播,或许有可能重现疫苗对天花病毒的“战绩”,根除病原体。

A族链球菌疫苗的开发历史极为复杂,同时面临许多挑战和障碍。A链球菌是一种复杂的病原菌,具有高度的基因组异质性和全球流行病学。不同血清型的变异性很大,导致很难开发一种通用疫苗来针对所有血清型。疫苗候选物的蛋白质序列变化也增加了疫苗开发的复杂性。此外,疫苗的效力和保护覆盖率预测与疾病负担和不同血清型的流行率相关,这在决定疫苗临床终点时增加了挑战。近期,一篇发表在NPJ Vaccines的文献,介绍了A型链球菌的主要组成——GAC,以及已发表的各种疫苗开发中的载体蛋白和连接技术。

A族多糖抗原(GAC)
上文提到,Lancefield血清分型可以区分A族链球菌和其他链球菌,A链球菌可以与其他β-溶血性链球菌区分开来。这项技术就是基于识别与特定抗体结合的类型特定的表面暴露的多糖抗原,化脓性链球菌因其表面存在A族多糖抗原(GAC)而被命名为A族链球菌。
A族多糖抗原(GAC)是A族链球菌(Strep A)或化脓性链球菌的特征之一。它是一种结构简单稳定的多糖,由线形多聚鼠李糖骨架和交替的GlcNAc侧链组成,其稳定性、表面暴露特点和抗原特异性使其成为A族链球菌疫苗设计的一大焦点。含有这种稳定多糖抗原的糖偶联物是构建通用A链疫苗候选疫苗的关键方法。
A族多糖抗原(GAC)在A群链球菌细胞表面上普遍存在,并被证实为细胞生存的重要决定因素。GAC在A族链球菌中的含量占比极高,占细菌细胞壁质量的40%-60%,具有提供结构支持作为环境屏障、维持细胞形态和促进细菌分裂的功能。此外,GAC也是主要的毒力决定因素,可对锌毒性提供抵抗力,并在感染过程中抵抗中性粒细胞的特异性杀伤。
GAC多糖抗原的平均分子质量为8.9?±?1.0?kDa,对应于18个重复单元。约25%-30%的GAC聚合物上的GlcNAc残基含有磷酸甘油修饰,这种修饰可能通过抵抗锌毒性来促进免疫逃避活动。缺乏GlcNAc的突变体更容易被人全血以及在纯化的人中性粒细胞存在的情况下杀死,这可能是由于阳离子人类防御肽、天青素、LL-37与突变体多糖的更大结合。GlcNAc的缺失似乎也减少了阳离子杀菌酶人类IIA分泌的磷脂酶A2与突变的细胞表面的结合。
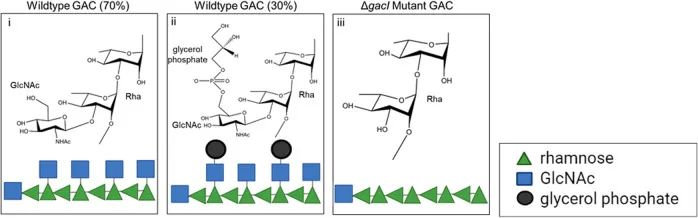
图1.GAC三糖重复单元的结构
GAC由聚鼠李糖骨架和GlcNAc侧链组成,用甘油磷酸酯装饰。野生型重复单元的70%为[3)α-L-Rhap(1→2)[β- D-GlcpNAc(1→3)]α-L-Rhap],30%在GlcNAc侧链上用甘油磷酸酯修饰(ii) [3)-α-L-Rhap-(1→2)[β-D-GlcpNAc6P(S)Gro-(1→3)]-α-L-Rhap-(1→3) ] 。ΔgacI突变体和某些在小鼠中传代的GAS品系具有重复结构[3)-α-L-Rhap-(1 → 2)α-L-Rhap-(1 → 3)-α],缺乏GlcNAc侧链
鼠李糖和GlcNAc侧链构成的支链多糖已经被证实具有免疫原性。已有研究通过抗血清、计算机模拟和核磁共振技术的相互作用验证了mAb和GAC之间的相互作用。GlcNAc侧链被认为在人类特定的病原性或免疫逃避策略中发挥作用。但在使用GAC用作疫苗成分时,需要考虑一个因素——GlcNAc存在于许多人类糖链结构中,并且与人类细胞外基质(ECM)成分相似,可能会引发自身免疫抗体的产生,这或许也是A族链球菌引发自身免疫性疾病的机制之一。
临床观察发现,急性风湿热(ARF)患者在感染点的抗GAC抗体滴度比咽炎患者高2-3倍,风湿性心脏病(RHD)患者的抗GAC抗体滴度更高。从ARF患者分离的单克隆抗体似乎只与野生型GAC发生交叉反应,而不与不含GlcNAc侧链的突变GAC发生交叉反应,这表明抗体对GlcNAc表位具有特异性。不过,GlcNAc的作用现在仍存在争议,大多数自身免疫反应被认为与ARF和RHD中的M蛋白有关。
抗体结合实验显示,GAC聚合物主要定位于细胞壁的外表面。这种表面定位、菌株间的稳定性以及保护特性使得GAC及其衍生物成为糖结合疫苗的重要组成部分。
GAC的免疫原性及载体蛋白的思考
免疫学研究表明,GAC与抗体结合形成复合物,经过亲和纯化后,抗GAC抗体具备调节M3、M6、M14和M28血清型的功能。感染A族链球菌的宿主会产生GAC特异性抗体,这些抗体的产生速度可能较慢,但据信会随着年龄增长逐渐增加,并在青少年时期达到高峰。一些研究表明,聚合物中GlcNAc侧链的某些部分,尤其是三糖重复结构中的分支点,在识别和激发吞噬细胞抗体方面起着重要作用。然而,最新的数据显示,抗体也能够识别聚合物主干内的鼠李糖表位。Rha-Rha-GlcNAc三糖已被证明可以与单抗结合,具有预防疾病的潜力。
此外,抗GAC抗体滴度与青少年中A链球菌感染率的降低有关,表明抗GAC抗体在长期免疫中起重要作用。多糖类抗原是T细胞非依赖性抗原,但与载体蛋白结合后可以提供T细胞表位,增强免疫反应。
理想情况下,选择作为糖结合疫苗中的蛋白载体的蛋白质应该具有自身的免疫原性。因此,合适的蛋白质载体必须能够有效地引发抗多糖免疫反应,并且与结合技术相兼容,同时具备安全性、高产率和低成本生产的特点。传统上,目前获得许可的糖结合疫苗中所包含的载体蛋白与所接种的生物体来自不同的来源。
目前已经获得许可的糖结合疫苗中有五种载体蛋白:破伤风类毒素(TT)、白喉类毒素、CRM197(白喉毒素的无毒突变体)、重组大肠杆菌产生的流感嗜血杆菌蛋白D和B群脑膜炎球菌的外膜蛋白复合体。这些传统载体蛋白已经成功地被应用于获批疫苗中,因为它们与结合化学物质相兼容,并且能够有效地引发持久的抗多糖免疫反应。
但最近对新载体进行的研究表明,在某些情况下,使用相同的经典载体重复接种不同的糖结合疫苗可能会抑制免疫效力和效果。这是由于先前存在的载体蛋白免疫引发的特异性B细胞和抑制性T细胞对多糖抗体反应的抑制作用,这种现象被称为载体诱导的表位抑制。
目前,保护性抗体针对蛋白质组分的潜在益处尚未得到充分开发。除了避免携带者特异性表位抑制外,同时包含病原体特异性多糖和蛋白质抗原的疫苗提供了一种“双重打击”的方法,可能实现更广泛的免疫效果。已经有几项关于稳定的链球菌A蛋白抗原作为疫苗候选的研究,通常包括在多组分疫苗中,这些抗原有可能被用作糖结合载体蛋白。合理设计的蛋白质抗原能够提高病原体特异性免疫应答,除了提供有效的T辅助细胞功能以改善多糖应答外,这也是链球菌糖结合疫苗的重要考虑因素。
糖偶联物的化学偶联
糖结合疫苗可以通过几种方法合成,而方法的选择也是一个重要的考虑因素,编辑部之前也为大家分享过糖结合疫苗的制作细节(相关阅读:什么是多糖结合疫苗?)。传统上,糖结合疫苗是通过化学结合来实现的,这需要直接从目标病原体的细胞壁或胶囊中提取和纯化多糖,并且还需要纯化重组表达的蛋白载体,然后才能发生两个组分的共价连接(图2a-c)。
偶联化学可以利用天然存在的反应性基团,或者添加交联剂来人工引入相容的反应性基团,或者通过活化连接来化学修饰组分。这两种修饰反应都可以提高偶联效率,但也会在此过程中破坏确认表位。化学修饰可以通过减少末端选择性激活,或沿着多糖链随机多次激活(图2d)。
化学偶联方法的选择通常受疫苗组分的结构、大小和组成的影响。例如,较大的多糖通常被随机激活,较小的多糖在还原端被激活以稳定保护性表位。通过调节组分化学计量比、靶向或引入特定的非天然氨基酸在蛋白质易化部位定向结合、靶向或引入特定的非天然氨基酸在蛋白质易化部位定向附着,可以实现一定的选择性。这种选择性或较温和的方法对于具有双重目的的载体蛋白来说可能很重要,使保护性的B细胞表位能够变得更加稳定。
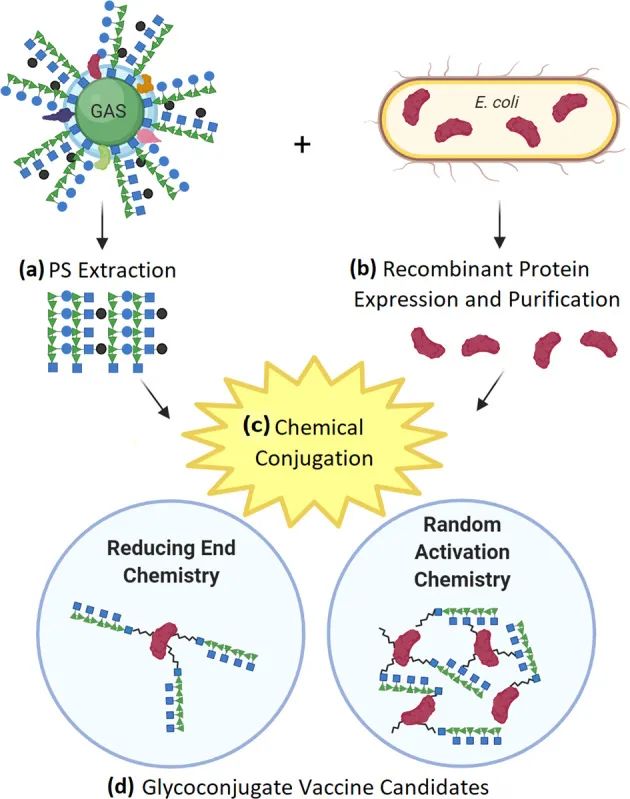
图2.化学偶联的简化示意图
从原生物体中提取的多糖(PS ),例如从A型链球菌细胞中提取的GAC(a),以及从大肠杆菌 细胞中表达和纯化的重组蛋白载体(b)。提取的PS和 含有兼容活性基团的重组蛋白载体 使用兼容的交联化学试剂将其连接在一起(c),根据选择的方 法产生异质的糖共轭疫苗(d)。示意图显示了不同的方法产生不同的糖共轭物种类,还原端化学反应导致终端单端糖共轭物 产品(类似太阳的结构),而随机活化化学反应产生的交联网 状结构的分子量较高,有几个连接的蛋白质-多糖分子。
GAC糖结合疫苗的研究进展
已有数项研究将GAC或GAC的成分作为候选疫苗进行研究。研究简要总结了关于GAC糖结合疫苗的关键研究以及选定研究的进展,并提供了关于这一主题的已发表研究的清单(表1)。
表1.含有A组碳水化合物(GAC)以及衍生的GACPR (聚鼠李糖)和所述合成聚合物的疫苗研究进展摘要
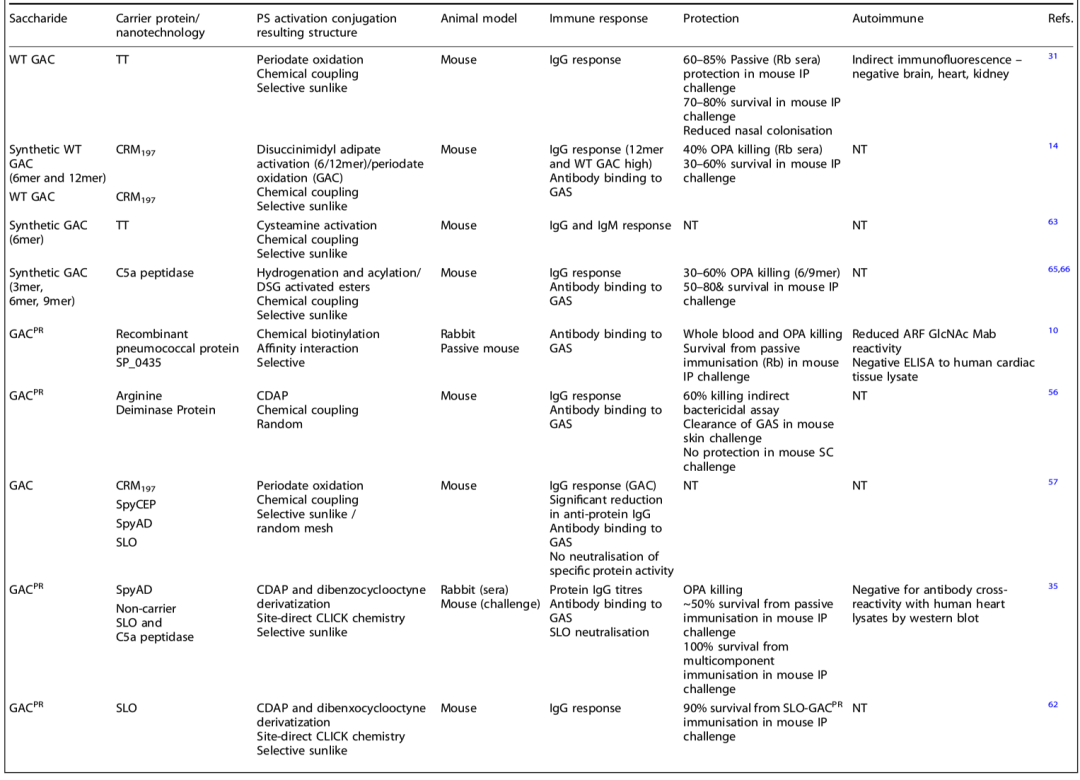
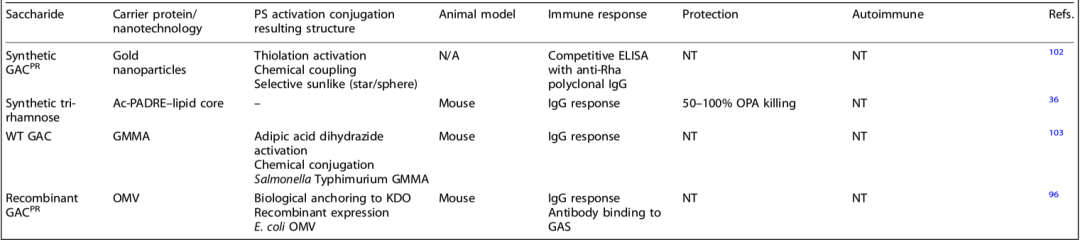
表中可以看出,早期的研究主要关注GAC与经典载体蛋白结合时的免疫原性,以确定抗多糖反应和用于保护的免疫表位。这些研究包括合成聚合物、天然GAC和突变为不含GlcNAc侧链的GAC(GACPR),改良的GAC或可减轻产生自身免疫反应的潜在风险。
近五年来,人们对将GAC作为疫苗成分重新产生了兴趣,这些研究基于将GAC纳入多组分配方或“双重打击”糖结合物的基础上,并利用化学方法进行偶联。
Sabharwal等人的一项早期研究中使用的与TT结合的原GAC的疫苗,显示了对小鼠鼻内定植和腹膜内侵袭性感染的保护作用,且对两种不同的M Strep A血清型都有效。该研究在Kabanova等人“将不同长度的合成聚合物连接到CRM197上,以研究大小依赖的免疫原性”的基础上进行。这些研究还证明,六糖(由四种鼠李糖组成,其中两种用GlcNAc侧链装饰)是能够引发强大免疫反应的最小表位,并能产生保护性抗体。这一结果重申了早期观察结果,并得到了一项进一步的研究的证实,该研究表明,当六糖半抗原与天然GAC结合时,具有与天然GAC相同的免疫原性。
研究人员通过使用改良的GAC疫苗,成功地解决了潜在的疫苗安全问题。这种疫苗能够产生抗体,促进对多种链球菌A血清型的吞噬杀伤,并保护小鼠免受全身感染。研究还发现,对GAC的修饰可以进一步提高免疫反应。此外,研究人员还强调了在使用特定蛋白质载体时保留蛋白质表位的重要性。他们发现,选择性结合是最有效的方法,并且使用改良的GAC疫苗可以提高保护效果并减少副作用。这些研究为GAC作为广泛保护性疫苗抗原的应用提供了基础。
结合物在所有产生的结合物中对GAC的抗体滴度都很高,而在所有结合物中对SLO的抗体滴度与单独的SLO变体相似。没有进行特定的SLO中和试验来证明保留的功能性中和抗体,但体内模型显示,与SLO和CRM197-GACPR免疫相比,SLO-GACPR结合物具有显著的保护作用。这成功证明了,GAC与链A载体蛋白的定点结合提供了对这两个组分的有效抗体反应和体内良好的保护作用。
尽管前景看好,但这里的结合物依赖于昂贵的化学结合物,这有一些限制,如技术挑战、低产品产率和批次之间的变化67。因此,替代的接合方法和疫苗结构有利于A链球菌疫苗接种,以降低成本和改善生产一致性。
GAC的蛋白质多聚糖偶联技术
近年来,蛋白质多糖偶联技术(PGCT)或生物偶联技术的发展提供了一种替代化学偶联的方法,在某些情况下甚至优于化学偶联, 且PGCT有可能简化糖共轭化合物的生产。目前,几种使用这项技术的疫苗正在进行临床试验。
PGCT这种生物偶联方法,依赖于原核细胞合成多糖并修饰蛋白质的能力。其中,N-连接糖基化是最常用的方法,利用空肠弯曲菌的PglB酶进行。研究中证明了pglB操纵子在大肠杆菌中的克隆和表达,并用于糖工程和疫苗开发。该系统通过将多糖合成到内膜上的脂质连接物上,并转移到周质中,最终连接到蛋白质上的识别片段上。细菌的N-连接糖基化发生在蛋白质折叠之后,因此可以在疫苗设计中增强糖基化修饰。
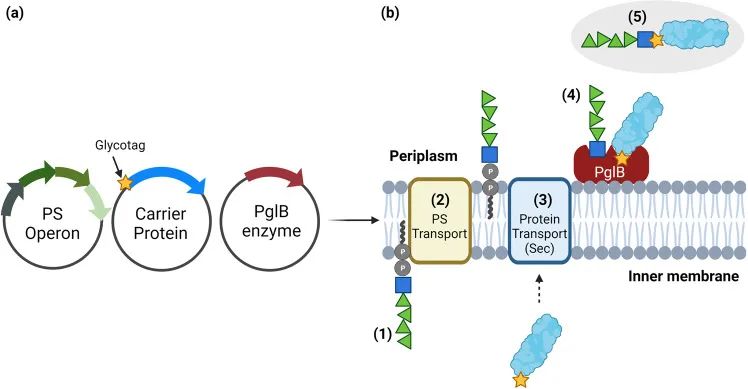
图3.利用空肠弯曲杆菌PglB在大肠杆菌宿主细胞内的生物结合生产糖结合物
将含有编码多糖类(PS)生物合成基因(绿色)、含有糖标签的蛋白受体(蓝色)(黄色星形)和寡糖转移酶(OST)PglB(红色)的质粒共转化到大肠杆菌宿主细胞中。B生物偶联物的产生如下:(1)PS生物合成位点被表达并构建在内膜内的十一烯醇焦磷酸(UnD-PP)脂质连接物上。(2)PS被一种特殊的Flippase酶从细胞质翻转到周质。(3)合成的载体蛋白通过SEC分泌系统输出到周质。(4)在周质中,PglB OST酶可以识别PS和含有特定糖标记物的载体蛋白。PglB将来自Und-PP的PS转移到完全折叠的载体蛋白上D/E-X-N-X-S/T基序中的天冬酰胺残基上,导致蛋白质糖基化。(5)随后可以从大肠杆菌细胞中提纯取之不尽的糖蛋白。
PGCT是一种可行的化学偶联替代方法,它具有以下优点:大肠杆菌系统可以产生大量完全合成的重组多糖资源,这些资源易于纯化,从而降低了成本并提高了产量。可惜的是,目前PglB酶的特异性限制了PGCT的前景。只有带有乙酰氨基的还原末端的多糖的C2位才能被野生型酶转化,通过定向进化突变,或许能够改变PglB酶可以缓解这一限制,从而提高转化的亲和性和转化效率。另外,替代的OST酶如PglL和PGLS也被广泛用于N-连接的糖基化和O-连接的糖基化。这些酶可以与带有半乳糖和葡萄糖端基的多糖发生反应。
随着对细菌结构的研究不断深入,我们将有更多机会利用PGCT为定制设计的糖结合疫苗开发提供支持,从而实现几乎任何糖与任何蛋白质的偶联。
此外,PGCT还提供了在给定载体蛋白上精确连接多个糖链的机会,这已被证明可以提高糖结合疫苗的效力。与通常的化学偶联方法相比,PGCT对蛋白质载体和目标重组多糖的改变最小。这些特点使得PGCT方法的应用能够更加灵活,而且不需要过于严格的化学偶联条件。
GAC的生物合成及重组鼠李糖结构的开发
GAC聚合物是由一个称为Gaca-L的稳定的12基因簇编码的(图4A)。在2083个被测试的链球菌基因组中,有2017个与整个12基因簇的DNA序列相似性>70%。操纵子中的前七个基因编码多鼠李糖骨架的生物合成,在其他链球菌组中稳定。另外3个基因与GlcNAc侧链的附着和修饰有关。鼠李糖的编码基因和L鼠李糖底物的可用性对于A链的存活是必需的。
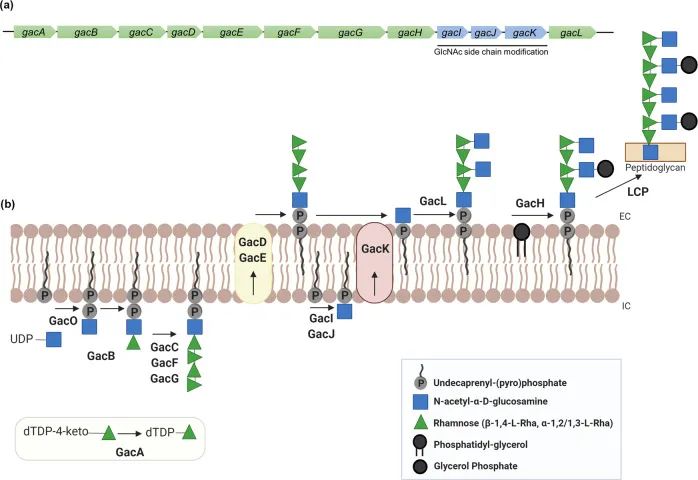
图4.链A中的GAC操纵子产生含有多鼠李糖骨架的GAC,该骨架上装饰着交替的GlcNAc侧链。
链A中Gac操纵子(Gaca-L)的示意图。水平箭头表示每个基因名称,颜色表示预测的基因功能。绿色,多鼠李糖生物合成;蓝色,GlcNAc生物合成。B GAC生物合成示意图。GAC的生物合成是在附着在周质膜内叶上的脂质连接的GlcNAc上启动的,以鼠李糖基转移酶(GacBCFG)催化合成多鼠李糖。聚合后,多鼠李糖骨架被ABC转运体(GacDE复合体)翻转到外层小叶,然后GlcNAc(GacL)和甘油磷酸(GACH)作为侧链修饰转移到多鼠李糖骨架上。假设LytR-CPSS-PSR(LCP)磷酸转移酶蛋白通过磷酸二酯键将GAC连接到肽聚糖上
通过PGCT开发GAC的理由是:变形链球菌中与GAC相关的鼠李糖骨架结构已经被表达并输出到大肠杆菌细胞表面,改变了内毒素的谱。变形链球菌中的天然鼠李糖生物合成途径与在大肠杆菌中表达和合成的重组途径相似。最近的研究表明,利用类似的重组方法,大肠杆菌细胞编码GAC鼠李糖骨架生物合成的基因,并产生装满糖的外膜小泡(OMV)。这项工作表明,GAC鼠李糖骨架可以在大肠杆菌中成功构建,并在小鼠和兔子身上产生针对A链球菌血清型的抗体。因此,该系统可作为链球菌A抗原进行PGCT的基础。然而,由于GAC链中的鼠李糖与GlcNAc通过特殊的连接方式相连,可能需要其他策略来通过PGCT转移A链鼠李糖聚合物。
03结语Concludingremarks
当下,全球亟需研发A型链球菌疫苗,GAS靶向糖结合疫苗领域也在蓬勃发展中。早期研究表明,GAC具有强大的免疫反应,故而当下的研究重点已转向含有物种特异性载体蛋白和GAC的“双重攻击”糖偶联物。这些糖偶联物可以是天然的或经过修饰的,以去除GlcNAc侧链。研究表明,选择性更温和的方法更适合于“双重攻击”的糖偶联物,以防止蛋白质免疫表位的屏蔽,而这类方法不易破坏蛋白质的结构和构象,从而确保其作为T细胞表位载体的作用,同时保护抗原本身。然而,由于限制了被激活并可用于附着的链的区域,这种方法可能会减少总体上的多糖附着。这在某些方面类似于生物偶联,即蛋白质载体在N-和C-末端带有糖标签,这更有可能保持蛋白质的稳定性和结构,从而保持B和T细胞表位。利用生物偶联技术进行A链球菌糖偶联物的生产研究,将有助于开发成本效益高的A族链球菌疫苗。
GMMA研究表明,不同的呈递机制和多糖抗原结构会影响T细胞反应的优势。较短的多糖抗原需要更多的T细胞帮助才能刺激免疫。载体蛋白可能是未来GAC疫苗所必需的,因为它能强烈刺激T细胞活性。多糖大小对B和T细胞相互作用的影响是已知的,需要进一步研究最佳蛋白质载体来诱导T细胞活性和GAC定向记忆反应。金纳米颗粒和自佐剂脂肽与GAC显示出潜力,重组技术可能满足全球疫苗需求的低成本解决方案。载体蛋白和葡聚糖可以精确操纵,糖链数量和长度可以根据需要增加和控制。
在构建经济实惠的A链疫苗候选疫苗时,考虑到低收入和中等收入国家(LMIC)的可负担性,在选择成分和技术时应慎之又慎。本研究讨论了关于A族链球菌疫苗新技术的前景,比如将PglB生物偶联用于鼠李糖聚合物偶联和膜抗原通用组件(GMMA),就被视为一种低成本的疫苗生产解决方案。合理设计的包含物种特定的糖蛋白和蛋白质成分“双打结合物”,可以生产出一种针对A链菌落的稳定疫苗,而不会引发自身免疫反应,值得深入挖掘。
总的来说,GAC是一种稳定的抗原,在所有分离的A型链霉菌株中都存在,因此建议将其作为一种通用的全球疫苗来对抗A型链霉菌感染。对于全球疫苗,特别是针对低收入和中等收入国家的疫苗,必须研究具有成本效益的糖合物生产解决方案,较新的技术(如PGCT和GMMA/OMVS)则显示出实现这一目标的巨大希望,因此有必要对GAC进行进一步审查。在研制A链霉菌糖结合物疫苗方面已经取得了令人印象深刻的进展,进一步研究双重打击结合物的生产和其对感染的保护将成为一种有价值的探索。
参考文献
[1]禹定乐,卢清华,尤元海,等.中国儿童A族链球菌感染相关疾病的诊断、治疗与预防专家共识[J].中华实用儿科临床杂志,2022,37(21):1604-1618.DOI:10.3760/cma.j.cn101070-20220815-00974.
[2]Burns K, Dorfmueller HC, Wren BW, Mawas F, Shaw HA.Progress towards a glycoconjugate vaccine against Group A Streptococcus. NPJVaccines. 2023 Mar 28;8(1):48. doi: 10.1038/s41541-023-00639-5. PMID: 36977677;PMCID: PMC10043865.